I processi di sterilizzazione.
La scelta dell’indicatore biologico adatto alle proprie esigenze deve essere fatta considerando alcune fondamentali informazioni, tra cui le caratteristiche del prodotto da sterilizzare, il processo di sterilizzazione utilizzato e le normative vigenti.
Una prima importante valutazione è il metodo di sterilizzazione che si intende usare.
Vengono solitamente raccomandati specifici ceppi batterici: il Bacillus stearothermophilus ATCC # 7953 per la sterilizzazione a vapore saturo e per la sterilizzazione/decontaminazione a perossido di idrogeno, il Bacillus subtilis var. niger ATCC # 9372 per la sterilizzazionea calore secco e ad ossido di etilene e il Bacillus pumilus ATCC # 27142 per quella con radiazioni.
La sterilizzazione a vapore saturo
Il metodo di sterilizzazione a vapore è il metodo più sicuro, economico, rapido e innocuo.
Il vapore infatti consente di distruggere i microrganismi coagulando la parte proteica delle cellule, cedendo in tempi brevi grandi quantità di calore.
Le apparecchiature che consentono di porre sotto pressione il vapore sono dette autoclavi, o più impropriamente sterilizzatrici, dotate di una camera a perfetta tenuta e resistente alle alte pressioni.
Ogni processo di sterilizzazione prevede che vengano individuati dei parametri da impostare e controllare durante un processo di sterilizzazione a vapore: la temperatura, la pressione ed il tempo.
Fra temperatura a cui vengono sottoposti i prodotti da sterilizzare e il tempo di esposizione a tale temperatura esiste una relazione inversa, mentre esiste una relazione diretta tra temperatura di esposizione e pressione in modo tale da essere garantita la presenza del vapore saturo all’interno dell’autoclave. Il tempo di esposizione all’agente sterilizzante viene stabilito in base alla temperatura del vapore.
La sterilizzazione si può ottenere alla temperatura di 121° C (con pressione di 1 bar) per un minimo di 15 minuti oppure alla temperatura di 134° C (con pressione di 2,1 bar) per un minimo di 3 minuti e la scelta dell’insieme dei parametri (o ciclo di sterilizzazione) è in funzione della tipologia del materiale da trattare.
Il metodo più sicuro per sapere se il ciclo di sterilizzazione è avvenuto correttamente all’interno dell’autoclave è l’indicatore biologico e la spora utilizzata per eccellenza è il G.stearothermophilus.
Gli Indicatori Biologici per i processi di sterilizzazione dei carichi asciutti:
Gli indicatori più comuni utilizzati sono le strip (cod. ST-106) di carta-filtro , inoculate con le spore di G. stearothermophilus che possono essere racchiuse in bustine permeabili all’agente sterilizzante o racchiuse in sistemi autocontenenti detti anche Self-contained (cod. MSCST-106), costituiti da una fialetta di plastica, con tappo marrone, perforato apicalmente, per rendere accessibile l’entrata del vapore al suo interno, in modo che possa agire sulla strip o dischetto inoculato con le spore. Sempre all’interno della fialetta, accanto alla strip o dischetto, è posta una fialetta di vetro contenente un terreno di coltura di formulazione particolare e un pH di viraggio (cod. PGM-100).
Solitamente vengono consigliati i sistemi self-contained, sia per questioni di sicurezza che per rapidità nei risultati; infatti le strip di carta subiscono molta manipolazione da parte dell’operatore e il rischio di contaminazione della strip stessa o del terreno è alto con conseguenza di falsi positivi, mentre nei sistemi self-contained, la strip rimane sempre protetta all’interno della fiala e il rischio di contaminazione è minimo.
Inoltre, con i sistemi self contained si ottengono risultati visibili già nelle prime 24 ore, mentre per le classiche strip, i tempi di incubazione sono di almeno 7 giorni.
Oltra ai classici indicatori biologici descritti sopra, ci sono anche indicatori di dimensioni minori, come le ministrip (cod. MTB-06), i fili di cotone (cod. TT-06) o i fili di acciaio (cod. WTB-06), adatti per essere posizionati in piccole aree, orifizi e tubi, e per i dispositivi medici, vengono solitamente proposte le sospensioni di spore ( cod. che possono essere direttamente inoculate nel prodotto.
Gli Indicatori Biologici per i processi di sterilizzazione dei carichi liquidi
Per i carichi liquidi, vengono consigliate le ampolline di vetro direttamente immergibili nei liquidi, poiché, all’interno di queste, si realizzano le stesse condizioni nelle quali si trova il liquido circostante.
Allo stesso tempo le spore non vengono a contatto con il prodotto, assicurando così che esso non ne alteri la vitalità. Il punto più difficilmente raggiungibile dall’agente sterilizzante, all’interno del liquido, è quello che si trova al centro del fondo del contenitore e ad un terzo della sua altezza. Per posizionare l’ampolla in quel punto si può ricorrere all’uso di filo di ferro, agganciando l’ampolla all’apertura del contenitore.
All’interno delle ampolle si trovano le spore, il terreno di coltura ed un indicatore che, in seguito all’accrescimento batterico, cambia visibilmente colore da viola a giallo. Al termine della sterilizzazione è sufficiente incubare le ampolle alla temperatura consigliata dal produttore e quindi, valutarne l’esito.
Sono disponibili ampolle di due dimensioni, da usarsi in relazione alla grandezza del contenitore ed alla quantità di liquido che vi è contenuta.
Le ampolle di Spore ampules 1 ml (cod. AT-06), misurano 58 mm x 10,8 mm circa e possono essere poste direttamente nei contenitori con il prodotto da sterilizzare, oppure accanto ad essi. Le ampolle di Mini spore ampules (cod. ATM-06) misurano circa 6,4 mm x 32 mm e sono adatte ad essere introdotte in fiale anche di dimensioni molto piccole.
La sterilizzazione a ossido di etilene
L’ossido di etilene è un prodotto chimico utilizzato in forma gassosa altamente tossico per i microrganismi con cui viene a contatto.
L’ETO presenta inoltre un effetto carcinogeno, teratogeno per l’uomo.
Essendo una sostanza infiammabile, tossica ed esplosiva, il suo UTILIZZO è disciplinato da una serie di norme inerenti il tipo di impiego, di deposito, i requisiti delle attrezzature, dei materiali di imballaggio e delle tecniche di controllo.
Il processo di sterilizzazione avviene per azione combinata di 5 fattori:
- CONCENTRAZIONE DEL GAS
- UMIDITA’
- TEMPERATURA
- PRESSIONE
- TEMPO DI CONTATTO
Dati gli effetti collaterali della sostanza in oggetto, si sottolinea l’importanza di degasificare forzatamente il materiale sterilizzato. Gran parte dell’ETO viene eliminato durante la fase di vuoto e viene scaricato nell’aria o in acqua in metodo opportuno per evitare danni a persone o ambiente.
La sterilizzazione con ossido di etilene (EtO) viene generalmente utilizzata per oggetti sensibili al calore o alle radiazioni, quali gomme e materie plastiche, fibre sintetiche e naturali, senza che queste subiscano alterazioni irreversibili di tipo fisico.
Per la sterilizzazione ad EtO è raccomandato l’uso di strip inoculate con spore di B.atrophaeus ATCC #9372 (cod. SA-06) o il sistema self contained SCBI (cod. MSCEA-06) analogo all’SCBI per la sterilizzazione a vapore, ma all’interno i dischi di carta sono inoculati con il B.atrophaeus ATCC #9372.
La sterilizzazione a calore secco
Gli sterilizzatori a calore secco sono stufe in cui circola aria calda, o per convezione naturale o per circolazione forzata (negli sterilizzatori industriali).
La temperatura si aggira normalmente tra i 160-170°C.
La pressione dell’aria all’interno di questi sterilizzatori è uguale alla pressione atmosferica. Il riscaldamento del materiale da sterilizzare all’interno di queste stufe è molto più lento che nelle autoclavi. Per raffreddare il materiale dopo sterilizzazione si arresta il riscaldamento dell’aria e si fa circolare all’interno aria fredda sterile.
La sterilizzazione a secco si utilizza soprattutto per materiali termostabili sensibili all’umidità come vetreria, strumenti e materiali di metallo, non per terreni di coltura.
Quando viene effettuata una valutazione biologica, questa si ottiene usando un indicatore biologico appropriato.
Gli indicatori biologici per la sterilizzazione a calore secco sono costituiti da spore di B. atrophaeus ATCC #9372.
Anche in questo caso vengono consigliate le strip tradizionali (cod. SA-06DH), ma solo ad una temperatura non superiore ai 170°C, in quanto a temperature superiori si potrebbe avere lo scollamento della bustina di rivestimento e rendere sensibile la strip alla contaminazione post processo.
Il calore secco a temperatura superiore a 2200C viene usato spesso per la sterilizzazione e la depirogenazione della vetreria. In questo caso, l’indicatore biologico può essere sostituito dalla dimostrazione di una riduzione di 3 log della quantità di endotossine termoresistenti.
La sterilizzazione/decontaminazione a perossido di idrogeno
Il perossido di idrogeno può essere considerato, relativamente parlando, come un “nuovo” metodo di sterilizzazione / decontaminazione. L’uso delle tecniche di sterilizzazione discusse sopra sono in circolazione da decenni, mentre solo recentemente il perossido di idrogeno ha preso piede come mezzo di decontaminazione / sterilizzazione su larga scala.
Questo metodo di decontaminazione / sterilizzazione presenta grandi vantaggi in quanto risulta essere poco dannosa per i prodotti trattati, amica dell’ambiente, rapida ed economica. Inoltre, il composto può essere utilizzato in una varietà di temperature e condizioni di umidità e non è richiesto alcun contenitore a pressione, quindi il perossido di idrogeno si è dimostrato molto utile per la decontaminazione di grandi volumi o aree, come stanze o interi edifici.
Coloro che utilizzano questo tipo di processo però, possono andare anche incontro a delle difficoltà.
Innanzi tutto, non può essere utilizzato per trattare presidi contenenti cellulosa, perchè assorbono il perossido, ma la fonte di vera frustrazione con il processo è dovuta alla mancanza di linee guida standardizzate. Non esistono parametri per decidere quale concentrazione di perossido da usare, quali potrebbero essere le variazioni nel vapore o portata d’aria, della turbolenza, della temperatura e dell’umidità tra isolatori.
Non ci sono regole di orientamento e la sezione 4.8 della norma ISO 18472: 2006 descrive solo i requisiti della strumentazione per un resistometro di perossido.
Un altro punto da prendere in considerazione è la popolazione di un determinato indicatore biologico utilizzato.
La popolazione influisce sulle prestazioni, ma non nello stesso modo in cui influisce sulle prestazioni del bioindicatore in un processo a vapore.
Per il vapore, il calore secco e l’ossido di etilene, la resistenza misurata è costante indipendentemente dalla popolazione; ad esempio, la resistenza di un indicatore in strip con popolazione 10^6 utilizzata nel ciclo del vapore a 121 ° C può essere di 1,8 minuti.
Analogamente, strip di carta inoculate con lo stesso crop starter di spore ma con popolazione inferiore, avranno comunque un D-value di 1.8 minuti.
Questo non lo si riscontriamo per il processo a perossido di idrogeno. Perchè? La risposta è semplice. La sterilizzazione/decontaminazione a perossido di idrogeno non è un processo di penetrazione per cui se ci troviamo uno strato troppo spesso di spore, quelle che stanno al di sotto non entrano in contatto con l’agente sterilizzante. Questa è una situazione che avverrà sempre, è sarà maggiormente evidente nelle superfici piatte che nelle superfici concave come i dischi e i coupon in acciaio. Nei dischi di acciaio si avrà questo effetto multilayer solo sul bordo del disco.
Ci sono due modi per affrontare il problema; uno sarebbe quello di usare un ciclo più aggressivo o più lungo. Un secondo metodo è quello di considerare indicatori biologici con una popolazione inferiore a 10^6, perchè meno spore vengono inoculate meno probabilità si avrà di avere uno strato pluristratificato.
Per gli utilizzatori dei processi di sterilizzazione/decontaminazione con il perossido di idrogeno, si raccomanda l’uso della nostra linea di IB in acciaio inossidabile (Cod. SDTT- SDGM -SDGT – SDAT – MWTH – WTH e TRI).
Gli indicatori biologici SDTT-0X sono dischi in acciaio dal diametro di 6 mm, inoculati con spore di G.stearothermophilus ATCC 7953 e sono disponibili con varie popolazioni (10^3/4/5 e 10^6). Sono imbustati in Tyvec/Tyvec e sono in confezione da 100.
Gli indicatori biologici SDGT-0X e SDGM-0X presentano le stesse caratteristiche degli indicatori biologici dal codice SDTT-0X ma sono imbustati in Tyvec/Mylar.
Disponiamo inoltre di altre due tipologie di IB e sono i minifili di acciaio (Cod. MWTH-06) che hanno dimensione 38 mm x 0.3 mm e i fili di acciaio (Cod. WTH-06) che hanno dimensione 38 mm x 1.5 mm ideal per tubi e lumi e altri dispositivi nel quale non è possibile utilizzare IB di dimensioni maggiori.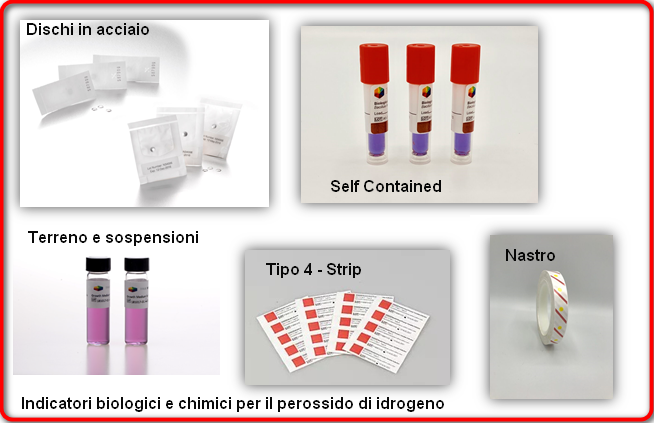
I fili hanno una struttura rigida che consente un facile inserimento e una facile rimozione da un dispositivo e la loro struttura in acciaio non assorbe l’umidità, ideale quando si ha condensa all’interno del lume.
I coupon di acciaio sono stati progettati principalmente per essere distribuiti in camere bianche o appesi in punti particolari di grandi isolatori.
La sterilizzazione a radiazioni
La procedura di sterilizzazione con raggi gamma utilizza le radiazioni del Cobalto 60 per uccidere microrganismi su una varietà di prodotti diversi. La procedura di irradiazione gamma garantisce tempi di elaborazione brevi, una facile penetrazione di imballaggi e prodotti ed è ideale per molti tipi di materiali.
Una caratteristica fondamentale dell’irradiazione gamma è l’elevata capacità di penetrazione.
Questo consente di processare prodotti moderatamente densi o sigillati con relativa facilità e di trattare in modo semplice prodotti pallettizzati. L’unità di dose assorbita è il kiloGray, espresso come kGy. La dose assorbita è determinata dalla densità del prodotto, dalle dimensioni della confezione, dall’intensità della dose, dal tempo di esposizione e in qualche misura dalla
progettazione dello stabilimento.
La procedura di sterilizzazione con raggi gamma può effettivamente sterilizzare un’ampia varietà di prodotti composti da materiali differenti, con densità, configurazioni e orientamenti vari.
Alcuni esempi di prodotti trattati includono:
- Dispositivi medici
- Prodotti farmaceutici
- Prodotti con combinazione di farmaci/dispositivi
- Strutture zootecniche
- Archivi
- Cosmetici e prodotti per l’igiene personale
- Forniture per orticoltura
- Imballaggi
La procedura di irradiazione con fascio di elettroni accelerati (E-beam) utilizza elettroni a energia elevata per una vasta gamma di applicazioni. La procedura di irradiazione con fascio di elettroni accelerati viene comunemente utilizzata per la sterilizzazione di dispositivi medici, per il controllo della contaminazione, nonché per modificare materiali come tubi termorestringenti e cavi e fili di isolamento.
Il bombardamento di un materiale con elettroni ad alta energia dà luogo a una cascata di elettroni che si spostano attraverso il materiale di destinazione stesso. Questi elettroni sono liberi di interagire con le molecole all’interno del materiale, espellendo gli elettroni dai loro orbitali e generando radicali liberi. Sono principalmente le reazioni dovute a tali specie a essere responsabili dell’abilità del fascio nel modificare i polimeri. Per ciò che riguarda la capacità sterilizzante del
fascio di elettroni è generalmente riconosciuto che siano tali specie a provocare la rottura della doppia elica del DNA, impedendone la replicazione o l’espressione e quindi a esercitare un’azione sterilizzante.
La procedura di irradiazione mediante fascio di elettroni accelerati è anche utilizzata come metodo
di controllo della contaminazione negli imballaggi, nei cosmetici e nei prodotti per l’igiene personale.
I bioindicatori consigliati per per la sterilizzazione a radiazione sono le classiche strip di carta filtro (Cod. PM-106) inoculate con il B.pumilus ATCC 27142 dalle dimensioni di 7 mm x 38 mm, confezionate singolarmente e le sospensioni di spore (Cod.VBP-106) con caratteristiche di resistenza note e vari livelli di popolazione standardizzati ogni 0,1 mL.
Le sospensioni di spore consentono l’inoculazione diretta dei prodotti, solitamente per verificare la sterilità dei dispositivi in cui non è possibile utilizzare indicatori biologici tradizionali, come le strip.
